

摘要:医药专利无效分析有助于衡量项目的可行性,通过对专利无效信息的总结梳理,把握目前仿制热点及专利审查趋势,及时跟进政策变化,协助确定研发过程中的侵权风险规避及产出新专利。在项目开发过程中,涉及多种类型专利的规避及无效问题,本文筛选了经典无效案例初步探讨了研发过程中的专利策略,其中晶型专利近年来审查标准逐渐严苛,不易规避,无效角度主要从晶型的预料不到的技术效果入手;组合物专利首选规避,可根据捐献原则、禁止反悔原则制定规避策略,避免等同侵权行为,组合物专利的无效可由辅料成分的含量种类或技术效果等为切入点。据此及时制定项目研发过程中的专利策略,推进立项及后续研发进程。

2021年新修改的专利法正式施行,以及《药品专利纠纷早期解决机制实施办法(试行)》的发布、中国上市药品专利信息登记平台的启用,标志着中国的专利链接制度已初步形成。在国内专利方面的法律法规逐步完善的情况下,企业如何在项目开发过程中做出适宜的专利声明、及时规避侵权或提起无效、做好企业专利布局对项目的评估及推动均有重要的影响。根据公司目前的研发现状,以项目中知识产权信息的评估具体要求,就2021年无效专利数据、专利链接的施行及具体代表性案例进行分析,以期在仿制药申报过程中专利策略的制定得到一定的启示。
据国知局专利复审和无效网站,2021年医药方面(不包括中药)的无效案例统计共计71件。以下对这些无效案例的数据进行统计分析。
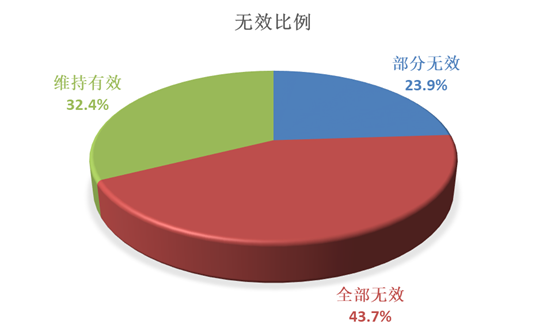
下图1可见,2021年医药方面的无效案例中,被宣告维持有效的案件占32.4%,被宣告部分无效的案件占23.9%,被宣告全部无效的案件占43.7%。
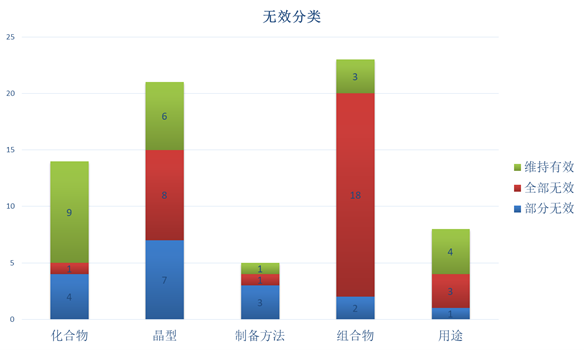
下图2可见,在维持有效的专利中,化合物占比最高,为39.1%;在全部无效的专利中,组合物占比最高,为58.1%;在部分无效的专利中,晶型专利占比最高,为41.2%。(组合物专利包括制剂专利、复方专利等;晶型专利包括盐型专利、水合物专利等)
下图3可见,在31件发明专利被全部无效的案件中,主要的法律依据是《专利法》第22条第3款(创造性),有少数专利仅依据公开不充分等非新创性理由被宣告全部无效。
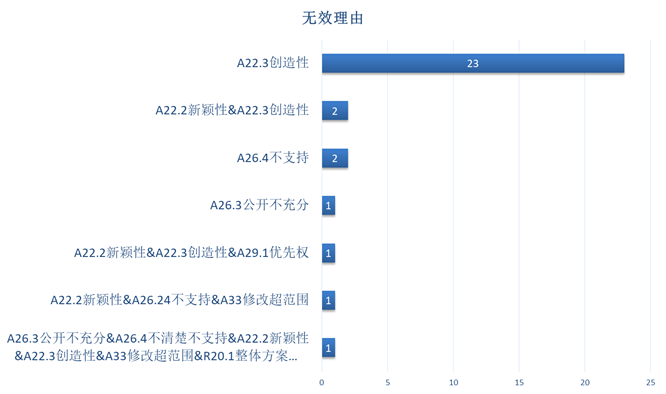
图3 无效理由
下图4可见,以“无效请求提出日”至“无效决定日”来计算审理周期。国家知识产权局对医药无效案件的审理周期大多数为6~10个月。
有少量案件的审理周期较短,为5个月以内,亦有少量案件的审理周期较长,为20个月以上。其中审理周期20个月以上的原因包括:批量案件、关联案件、权利要求数量过多、专利权转让、保全、涉及行政诉讼或因行政诉讼重新作出决定等。
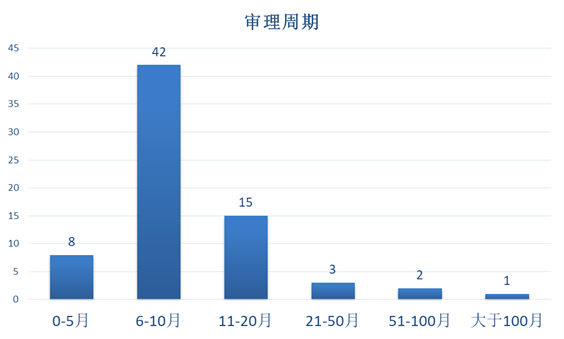
图4 审理周期
下图5可见,专利权的维持年限(“授权公告日”至“无效决定日”)以6-10年的最多,其次为0-5年,维持年限较长的专利较少。
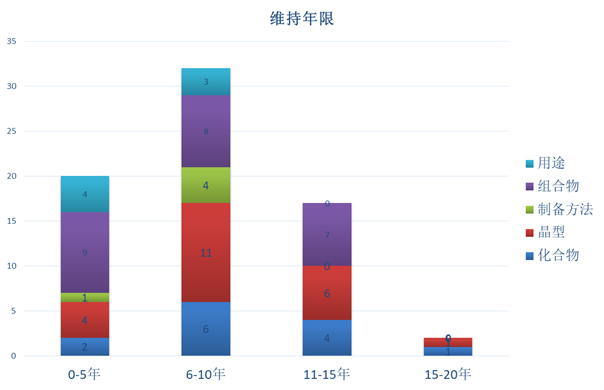
图5 维持年限
第四次修订后的《专利法》自2021年6月1日实施以来,药品专利链接制度已在我国运行近一年。特别是随着中国上市药品专利信息登记平台的建立,以及《药品专利纠纷早期解决机制实施办法(试行)》、《最高人民法院关于审理申请注册的药品相关的专利权纠纷民事案件适用法律若干问题的规定》、《药品专利纠纷早期解决机制行政裁决办法》等各项细化规则的出台,我国药品专利链接制度下的专利信息登记、专利声明、专利挑战、相关行政裁决及法院诉讼等各项程序也开始从理论探讨走向实践。我国目前尚处于起步阶段,现有规则仍有待于在实践中发现问题、解决争议、逐步完善。以下对药品专利纠纷早期解决机制下仿制药申请人做出的第四类声明进行汇总分析,探究近一年来国内专利链接制度的施行情况。
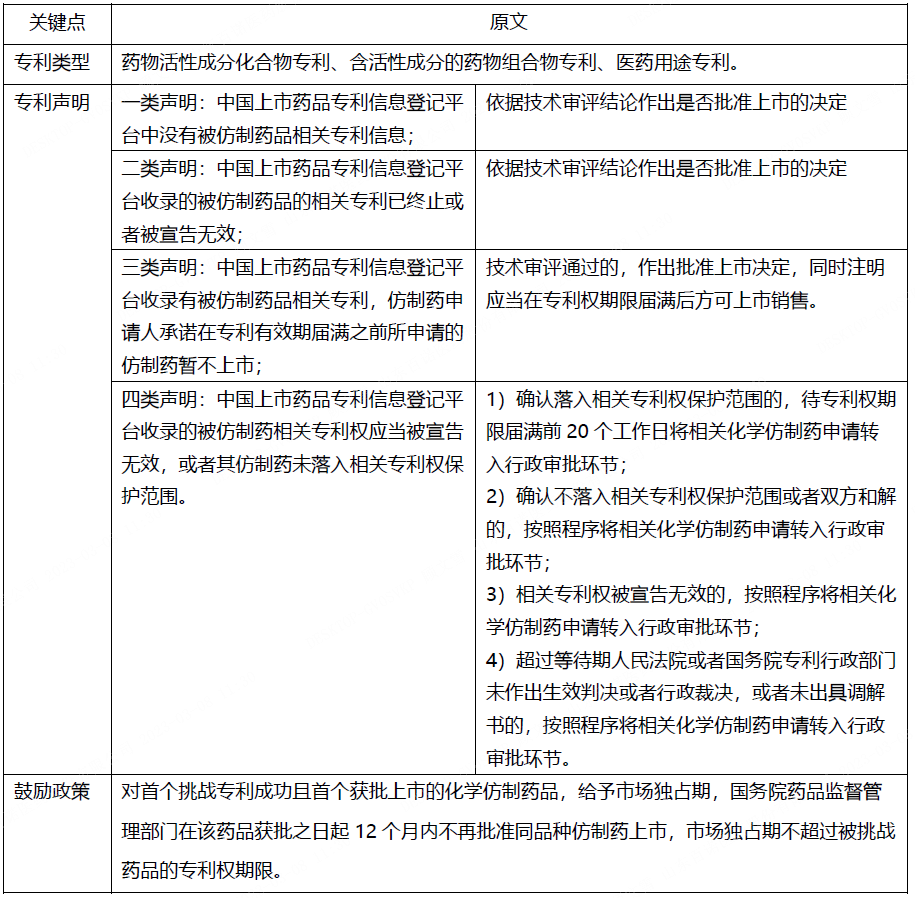
专利信息登记平台规定的专利类型、专利声明总结见下表1。本文重点关注四类声明,即中国上市药品专利信息登记平台收录的被仿制药相关专利权应当被宣告无效(4.1类),或者其仿制药未落入相关专利权保护范围(4.2类)。
表1 专利链接制度
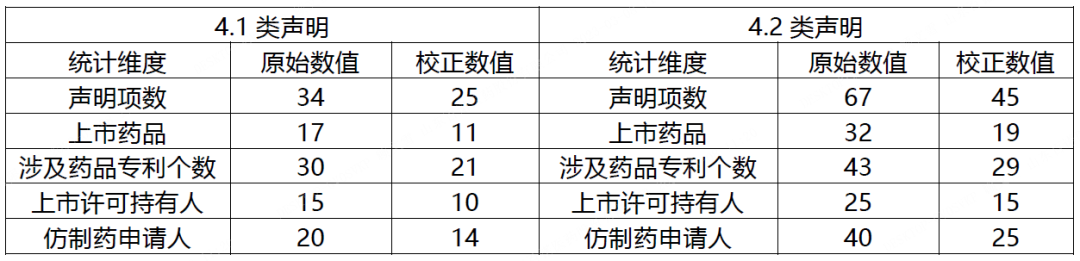
截至2022年4月,通过下表2中校正后的统计数据可以看出,近一年来共有14家仿制药申请人向10家药品上市许可持有人提出4.1类声明,涉及11款上市药品、21项专利;共有25家仿制药申请人向15家药品上市许可持有人提出4.2类声明,涉及19款上市药品、29项专利。
表2 四类声明总体统计
2.2.2 上市许可持有人
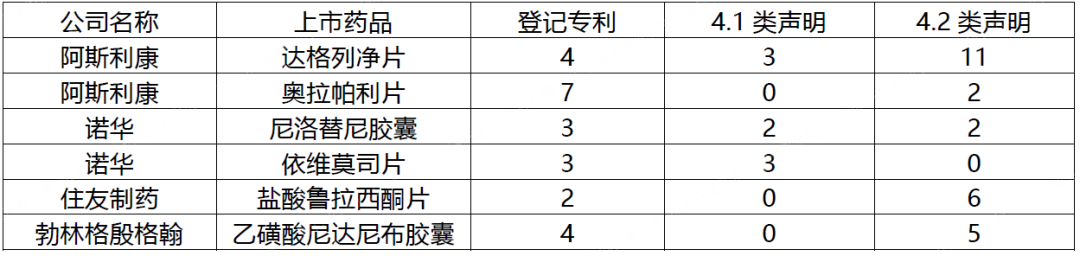
在所有药品上市许可持有人当中,阿斯利康可能是我国药品专利链接制度实施当下应对最为繁忙的原研药企,近一年来收到来自五家仿制药申请人的四类声明共计16项,其中针对糖尿病药物达格列净片的四类声明多达14项,另外2项涉及抗癌药奥拉帕利片。另外,诺华、住友制药、勃林格殷格翰也均收到多件四类声明,但每家原研药企涉及的上市药品仅限于1-2款(具体见下表3)。上述原研药企通过在先的专利布局和当下的专利登记策略,使得每款药品均对应多项专利,这或许是四类声明数量集中的原因之一。同时,针对重磅上市药物的仿制研发间也存在激烈竞争,多家仿制药企业就同一重磅药物先后提出仿制药上市申请,也是导致这些药物的四类声明集中的另一原因。
表3 代表性药品上市许可持有人
虽然《实施办法》中还对首仿化学药给予市场独占期的激励,但从目前的制度运行实际看,其激励作用似乎并不明显,这也体现在4.1类声明的数量远低于4.2类声明及其他类型声明,与4.1类声明相关的案件数量也低于预期。
截至目前,能够符合《实施办法》第十一条所定义的“挑战专利成功”的实际案例尚未出现,究竟哪家制药企业能够获得以及能在何时获得首个市场独占期,仍需拭目以待。
国家知识产权局2021.08.03公布的《专利审查指南修改草案(征求意见稿)》中规定,涉及药品专利纠纷早期解决机制的无效案件是指仿制药申请人提出第四类声明后,就声明针对的专利提出无效宣告请求的案件,并需附具仿制药注册申请受理通知书和第四类声明文件的副本等相关证明文件。因此,如果《指南修改草案》的上述规定正式通过并实施,则在作出4.1类声明之前提交的无效宣告请求将不能作为“涉及药品专利纠纷早期解决机制的无效案件”审理,进而可能无法获得审查时限、审查程序等方面的特别保障。而如果《指南修改草案》的上述规定未获通过,则仿制药申请人仍可采用在仿制药申报注册之前就提出无效宣告请求,待作出4.1类声明时再视无效宣告请求案件进展来考虑是否补交相关证明文件的策略。
从上述数据分析可知:首先,无效周期平均为6-10个月,若在研发过程中有无法规避的关键专利需要提起无效请求,需在研发周期中规划相应时间节点;其次,全部无效专利中组合物专利占比最高,部分无效专利中晶型专利占比最高,由此可见,组合物专利和晶型专利的稳定性相对不高,研发过程中涉及侵权这两类专利的可以考虑提出无效请求。